(分子シミュレーション研究会誌「アンサンブル」2010年7月号に投稿)
はじめに
塩は水に溶けるが、気体分子は水にほとんど溶けない。それは、水分子が分極しているため、イオンとの間には強いクーロン相互作用が働く一方、電気的に中性な気体分子とは弱いファンデルワールス相互作用しか働かないからである。前者は親水性、後者は疎水性と呼ばれる。
ところが、これらが水とともに凍る場合、つまり固溶体になる場合は全く様相が違う。食塩水を凍らせようとすると、塩が排出され、最終的には純氷ができる。逆に、気体分子の場合には、液体に溶ける量をはるかに凌ぐ気体が水とともに結晶化し、包摂水和物(ガスハイドレート)となる。水への溶けやすさと、固溶体になりやすさが全く逆なのである。水溶液が結晶化する際には、このことが水特有の様々な興味深い現象を生みだす。
包摂水和物(以下ハイドレートと呼ぶ)の構造は、大きくわけて、I型、II型、H型などに分類される。いずれも、水の水素結合が形作る非常に特徴的なカゴ状の構造の中に、ゲスト分子がとらえられており、ゲスト分子と水分子の相互作用はそれほど強くない。[^1](^1)逆に、水との相互作用が強い場合には、溶質が水のネットワークを壊してしまうので、うまくハイドレート構造を作ることができない。どの構造が選ばれるかは、ゲスト分子の大きさでおおよそ決まる。メタンやキセノンぐらいの大きさの分子であればI型、それより大きくても小さくてもII型が安定であることが知られている。ゲスト分子がある程度大きい場合、小さいケージは空になる場合があるが、以下では話を単純にするため、各ケージにはゲスト分子が1つ入っているものとする。
ケージとゲスト分子
ゲスト分子が疎水性なので、ハイドレートを凝集させ安定に保っているのは疎水性相互作用による引力であるように思える。しかし、単純な疎水性相互作用であれば、ゲスト分子同士が直接隣接した時に最も安定になり、結果としてゲスト分子は水を排除して凝集し、あぶくとなって水から抜け出てしまうだろう。実際のハイドレートの構造では、水の単分子膜とも言えるケージ構造が、ゲスト分子をひとつずつくるんだナノスケールの泡のような構造になっている。ゲスト分子同士が接するよりも、水の単分子膜が介在したほうが安定になるからこそ、ハイドレートが形成されるのであり、一般的な疎水性相互作用(疎溶媒性相互作用)とは仕掛けが異なる。1
ハイドレートの立体構造を見ると、目につくのは水の作る多面体のケージ構造である。ハイドレート構造の骨格を作っているのは水であり、ゲスト分子はその名の通り、水が作った構造のなかに居候しているように見えるが、はたしてほんとうにそうなのだろうか。
ハイドレートの構造は、図で見てもよくわからないぐらい複雑である。試しに分子模型で、水分子をつないでこのケージ構造を組み立てようとしても、格子の対称性や、ケージの隣接関係がしっかり頭にはいっていないと、たいてい間違った順序でケージをつないでしまうだろう。これは、ハイドレートの単位格子がかなり大きいからだ。例えばII型ハイドレートの場合、単位格子のなかに、水が136個、ゲスト分子が24個も含まれている。
しかし、これをケージの集まった構造ととらえると、構造がかなりわかりやすくなる。例えば、12面体ケージの場合、1つのゲスト分子が、20分子の水が作る正12面体にとりかこまれている。水は正12面体の各頂点に、そして水同士をつなぐ水素結合は、正12面体の辺に対応する。そして、正12面体の1つの面の両側には、ゲスト分子が1つずつ配置されており、12面体ケージであれば、12枚の面の外側には、12分子のゲストが配置され、それらのゲストもまた多面体(12面体とは限らない)に囲まれている。ハイドレートの構造には、水が形作る5角形と6角形がたくさん見付かるが、それらすべての面の両側には、必ずゲスト分子が1つずつ存在するのである。
1つのケージにはゲスト分子が1つ含まれていて、1つの面は2つのケージに共有され、1つの辺は3つのケージに、1つの頂点は4つのケージにそれぞれ共有されている。蛇足だが、面と面のなす角度はいつもほぼ120度、辺と辺のなす角度はいつもほぼ109.5度である。これらは、泡(foam)の基本的な構成規則である、Plateauの法則そのものである。2 ハイドレートの構造が泡の構造に似ているのも当然である。[^2](^2)
正四面体と正八面体
すべての頂点が、4つのケージに共有されているということは、つまり1つの水分子には、必ず4つのゲスト分子が配位しているということだ。隣接するゲスト同士を線でつなぐと、四面体を描くことができ、その重心位置には、水が必ず1分子存在する。逆に、水分子から周囲をみわたすと、4つのゲスト分子が視界を覆うように水分子のすぐ横に必ず存在するので、水はそれら4分子がない方向(四面体を構成する4つの三角面の重心方向)に水素結合を伸ばさざるをえない。四面体の双対構造(面の重心同士をつないでできる構造)もまた四面体なので、水分子はうまいぐあいにゲスト分子をさけつつ、自身の好む正四面体ネットワーク構造を維持することができる。水が四面体型ネットワーク構造になろうとするのを、ゲスト分子がさまたげないから、両者が共存して固溶体を作れるとも言える。(図1)
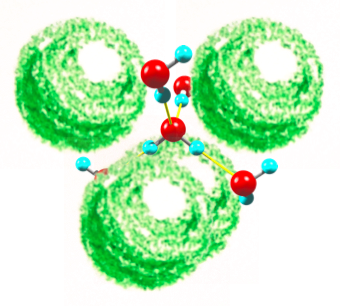
図1 四面体配置の4つのゲスト分子と、それに囲まれた水の四面体ネットワーク構造。
ところで、球を正四面体に配置すると、充填率を最も高くすることができる。最密充填構造と呼ばれる、面心立方格子や六方格子では、球は正四面体もしくは正八面体型に充填されており、正四面体と正八面体の存在比は正確に2:1、充填率は74%である。
正四面体と正八面体は、どちらも最密充填構造を構成してはいるが、実際どちらも同じ密度と言えるだろうか? 実際に、正四面体が切りとる球の立体角と、正八面体が切りとる立体角を、それぞれの立体の体積と比較して充填率を計算すると、表1のように、正四面体のほうが6%も充填率が高いことがわかる。最密充填構造は、3個に1個ずつ正八面体が入っているせいで、正四面体だけで充填するのに比べて充填率が4%ほど低くなっている。
表1 最密充填構造を構成する多面体の充填率。多面体の一辺を2、球の半径を1とする。
理屈の上では、正四面体だけで空間を埋めれば、最密充填構造よりも高密度な構造が作れそうだが、 正四面体の面同士をくっつけていくと、ギャップができてしまうため、ユークリッド空間では正四面体だけで埋めつくすことは不可能である。 [^3](^3)
四面体のみで空間充填
さて、ハイドレートのゲスト分子は、水分子の周囲に四面体型に配位していると上で書いた。では、ハイドレートのゲスト分子の配置は、最密充填構造になりうるだろうか。
答は否である。もし、ゲスト分子が八面体配置になると、八面体の内部の空間は、水1分子が入るには大きくなりすぎるし、正四面体ネットワーク構造を維持することができなくなってしまう。ゲスト分子は、水分子と共生できる正四面体配置だけを好み、正八面体にはなりえず、最密充填構造になることもできない。
一方、正四面体では空間を埋めつくせないことも書いた。 ハイドレートの中では、ゲスト分子はやや歪んだ四面体をうまくタイリングしていると考えられる。実際、I型およびII型の結晶構造は、やや歪んだ四面体のみで埋めつくされていることが確認できる。ゲスト分子配置から見ると、ハイドレートの構造は、四面体が空間を埋めつくした構造(polytetrahedral)と言える。
Frank-Kasper相
では、四面体だけで埋めつくせる結晶構造は、I型とII型で使われているゲスト分子配置以外にもあるのだろう。あるのなら、なぜそれらはハイドレートの構造には使われないのだろう。
実は、四面体だけで構成される結晶構造は、金属や合金構造としてはよく知られており、Frank-Kasper相 (以下FK相と表記) と総称されている。今から50年以上前に、Frankらは正四面体だけでできた結晶群の構成規則を探りあて、そのバリエーションが無数にあることを示し、さらにいくつかの未知の結晶構造を予測した。(それらは後に実際に発見された。)4
FK相では、原子の配位数は12、14、15、16のいずれかである。隣接原子の間に二等分面(Voronoi面)を配してWigner-Seitzセルに分割すると、セルはそれぞれ12、14、15、16面体となる。いずれもほぼ正5角形の面が12面あり、14、15、16面体はさらにほぼ正6角形の面がそれぞれ2、3、4面ある。なお、トポロジー的な要請により、5角形と6角形の組みあわせでは13面体は構成できない。
原子の位置にゲスト分子を置き、Wigner-Seitzセルの頂点に水分子を置き、辺上に水素結合が沿うように分子を配向させると、任意のFK相から、対応するハイドレート構造を構成することができる。つまり、FK相が無数にあるので、ハイドレート構造のバリエーションもまた無数にありうる。
代表的なFK相としては、P相(Mo42Ni40Cr18)、σ相(Cr14Fe16)、Z相(CaCu5)、μ相(Mo6Ni7)、そしてA15構造(Nb3Sn)およびC15構造(Cu2Mg)などがある。(図2) A15およびC15の原子配置は、I型およびII型ハイドレートのゲスト分子位置に一致する。また、Z相では2つの14面体セルが隣接しているが、これらを連結して大きな20面体ケージにすることで、H型ハイドレートの構造ができる。これら以外のFK相に対応するハイドレートも少数ながら見付かっている。5

図2 様々なFrank-Kasper相のWigner-Seitzセル構造。左上から横向きに、A15構造(I型ハイドレートと同型)、C15構造(II型ハイドレートと同型)、μ相、P相、σ相、Z相(H型ハイドレートに近い)。12、14、15、16面体をそれぞれ青、水色、緑、黄色で塗りわけた。 FK相から誘導された多くのハイドレート構造では、多面体セルの辺の長さはほぼ均質で、頂点での辺の配向もほぼ四面体型になっており、水の水素結合ネットワーク構造としても理想に近い構造となっているため、ポテンシャルエネルギーも拮抗している。それにもかかわらず、実験ではA15やC15がもっぱら観察されるので、それらが安定(低い自由エネルギーを持つ)であることは間違いない。しかし、計算機シミュレーションのように高分解能な観測装置で観察する場合には、準安定な構造の多様性を無視することはできない。例えば器壁や気液界面付近からハイドレート結晶が成長する時、あるいは逆にハイドレートが分解する過程、あるいは結晶構造間の相転移が起こる時など、相転移が起こる過程で、準安定な中間構造が介在する可能性は十分ある。準安定構造の多様性を考慮に入れて解析する必要がある。
なお、FK相は、準結晶の近似結晶構造としても知られている。準結晶とは、通常の結晶構造に許されない回転対称性(5回、10回、12回対称性など)をもつ固体構造である。FK相になる合金は、成分比や生成条件によっては準結晶になる可能性がある。そうして得られる準結晶もまた、四面体だけで構成されているはずであり、そのWigner-Seitzセルはハイドレートに見られるのと同じ多面体ケージ構造になっているはずである。また、二元合金よりも三元合金のほうが安定な準結晶ができると言われている。これらのことから類推すれば、3成分の気体の分子サイズと混合比をうまく調節することで、準結晶ガスハイドレートを作ることができるかもしれない。
謝辞
- 謝辞
メタンハイドレートが結晶化する過程を、3年がかりの分子動力学シミュレーションで実際に再現して見せてくれた、北岡勇樹氏(名大院理)に最大の謝辞を送ります。また、本記事の着想にあたり、堂寺知成氏(近大)、山室修氏(東大)、大峰巌氏(分子研)、神谷基司氏(京大)、菊地龍弥氏(東大)にはご助言や議論をしていただきました。ここに謝意を表します。
[^1](^1): ゲスト分子が水と水素結合を作る場合もある。準クラスレートと呼ばれる。 [^2](^2): 実際、 等しい体積の泡で作られる構造のうち、最も表面積が小さい構造は、I型ハイドレートそのものである。3 [^3](^3): 非ユークリッド空間であれば、四面体で埋めつくすことができる場合がある。ひとつ次元を下げて考えてみよう。2次元平面(2次元ユークリッド空間)を、正五角形でタイリングすると必ずギャップができてしまうが、球面上であれば、球の半径をうまく正五角形の大きさにあわせることで、正五角形で球面を埋めつくすことができる。同じように、3次元ユークリッド空間を正四面体で埋めつくすとギャップができるが、超球面の上では、正四面体で埋めつくすことができる場合がある。
References
- M. Matsumoto, to be published in J. Phys. Chem. Lett. (2010).
- Jean E. Taylor, The Annals of Mathematics, 2nd Ser., 103, 489 (1976).
- Weaire D and Phelan R, Phil. Mag. Lett. 69, 107 (1994)
- F. C. Frank and J. S. Kasper, Acta Cryst. 12, 483 (1959).
- V. I. Kosyakov and T. M. Polyanskaya, Journal of Structural Chemistry, 40, 239 (1999).
