水はありふれた物質? 変わった物質?
(理科教室2019年7月号に寄稿)
水に満ちあふれた世界
宇宙から地球を眺めると、水と雲と氷(雪)がほぼ全表面を覆っています。生物は水の中で発生し進化してきました。私たちの生活も水に深く結びついていますし、科学・工業・食品・農業・医療などのさまざまな産業も、水とは切離せません。あまりに身近であるために、私たちは物質の性質を考えるときに、ともすれば水が普通だと考え、水を基準にして比較してしまいがちですが、ほかの物質と比較すると、水はいささか変わった性質を持っています。例えば、汗をかいたり水に氷をうかべて飲んでいる時に、水の異常性を実感する人はまずいないと思います。しかし、他の物質と比べて水の蒸発潜熱は非常に大きいし、融ける時に体積が縮む物質は非常に稀です。水に隠された変わった性質はどのくらいあるのかは、水だけを見ていたのでは気付かないのです。
いや、「いささか」と呼ぶのは慎しすぎかもしれませんね。科学者はさまざまな物質を調査し、共通の性質や規則性をみつけてきました。その立場から言えば、水は「ものすごく」変わった物質と言っても過言ではないでしょう。英国のM. Chaplin先生は長年にわたって水の性質をウェブにまとめてきました。1 それによると、水の異常な性質は74にも上り、まだ増えつづけています。(表1) なお、この表にある項目はどれも水そのものの性質であり、水が関わる現象(生体内での水の役割や、化学反応の場としての水など)に視野を拡げると、水ならではの性質というのはほかにもまだまだあるように思います。
水も分子でできている
はじめに、水や氷を作っている部品である、水分子についてすこしおさらいしましょう。水分子は2個の水素原子と1個の酸素原子からなる小さなV字型の分子で、化学式はH2Oです。(図1)

図1 水分子の形。1 pm(ピコメートル)は1兆分の1メートル。
化学者は、いろんな分子を合成し、これまでにない機能を分子にもたせようとしています。そのために、何十もの原子がつらなり、複雑な構造をもった分子を合成します。分子を高度にデザインすることで、高度な機能や変わった性質を与えられます。最近では分子でできた車を、金属表面上で走らせて走行距離を競うナノカーレースが開催されて話題になりました2 が、日本から参加したナノカーは88個の原子からできた複雑なものでした。生物が利用しているタンパク質やDNAはこれよりもはるかに複雑です。典型的なタンパク質は数千原子、DNAは数千億個の原子からできています。
その観点から言えば、たった3つの原子でできた水分子はこれ以上ないほどシンプルな分子であり、とても何か特殊なことができそうには見えません。たくさんの原子が結合してできた分子を高分子と言いますが、水のようにほんの数個の原子だけでできた分子は対比として低分子と呼ばれることもあります。高分子には無限にバリエーションがあります。すべての生物が異なるDNAという高分子を持っているということは、高分子には生物を作るほどの高度な機能を持たせられるということ、一方で、高分子のあらゆる可能性を調べつくすことはとても無理そうだということがわかります。無限の多様性をもつ分子のなかで見比べると、水はきわめつけに単純な分子です。水より分子量が小さい分子は、水素、ヘリウム、アンモニア、メタンの4つしかありません。これらの分子は、簡単で軽いがゆえに、宇宙全体にあまねく存在します。おそらく、宇宙ができたごく初期からすでにこれらの分子は存在していたのでしょう。こんな単純な分子が、変わった性質を持つことがありえるでしょうか?
実はそれがあるんです。水の異常な性質のほとんどは、水分子1個が持つ性質ではなく、分子がたくさん集まってはじめて生じる性質です。たくさんの糸から布ができることを考えても、単純な素材でもたくさん集まれば違う性質や機能がでてくるというのは、たしかにありそうな話です。ほかの単純な分子でも、たくさん集まることでそれぞれ一分子にはなかった性質や機能が生じます。でも、水分子が集まった場合には、ほかの物質に比べて異常に見えるということは、水分子の集まり方に、何か違いがあるのかもしれませんね。
水素結合の驚異
水分子の中で、水素と酸素原子をつなぎとめている力は共有結合と呼ばれ、非常に強い結合の一種で、これを熱で切りはなして水分子を分解するためには、3000℃まで熱する必要があります。3 この温度は、水素ガスと酸素ガスを混ぜて爆発させて水を得る反応の温度とほぼ同じです。これに対して、水や氷のなかで、水分子同士を結びつけている力は水素結合と呼ばれる弱い力で、100℃で切りはなせます。(その結果、水は沸騰し蒸発します)
とはいえ、小分子仲間である、メタンや水素の分子間に働く引力(ファンデルワールス力)に比べれば、水分子間の水素結合はかなり強いほうなので、メタンや水素が沸騰してガスになってしまうような常温でも、水は沸騰せず液体のままです(水素の沸点–259℃、メタンの沸点–161℃)。
水が変わった性質をたくさん持つのは、この水素結合にひとつの原因があります。水以外の物質でも、水素結合を作るものはいろいろあります。さきほどでてきたDNAなどもそのひとつです。DNAの2本のらせんをほどけないようにくっつけ、遺伝情報を誤りなく記録するために、水素結合が使われています。水素結合を使うことで、必要に応じて結合を切ったりつなぎなおしたりすることが容易にできます。このため、生物のからだで使われる分子のうち、形が変化する必要があるものには、必ず水素結合が使われています。水素結合のつながり方を変えることで、形が変えられ、機能を生みだせるわけです。
では、この使い勝手のよい水素結合を一番たくさんもっている物質は何でしょう? そう、それが水です。(図2) ほかの物質に比べて水素結合の数が圧倒的に多いことも、水が極めて個性的である理由のひとつです。
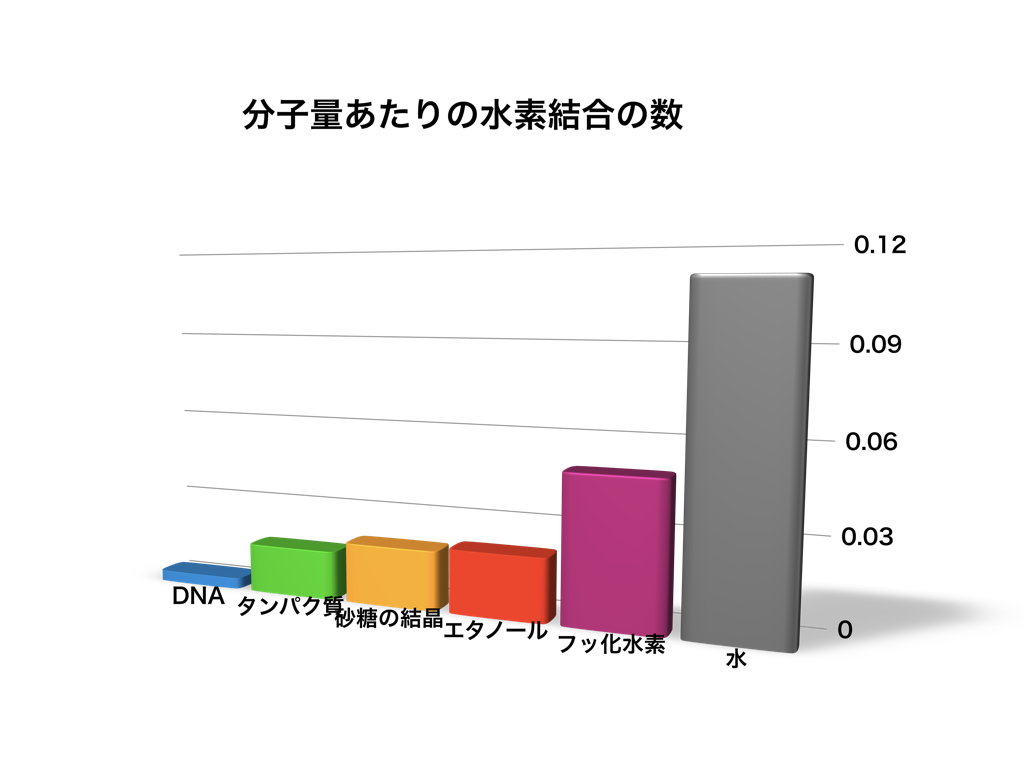
図2 分子量あたりの水素結合の数。DNA、タンパク質と周囲の水の間の水素結合は含んでいない。ほかの分子は結晶状態での値。
その性質、実は異常です
表1にあげた通り、水にはとてもたくさんの異常な性質がありますが、その中には同じ原因の現象を、いくつもの異なる物性値で観察しているものもあります。あとでこれらをできるだけ整理してみます。また、これらの性質のなかには、すでに慣れていてその異常性に気付かないものもたくさんあります。しかし、水にその性質がなかったとしたら、世界は全く違ったものになっているはずです。
例えば、21番の「水の膨張率は低い」は、17番の「過冷却〜融点よりすこし上の温度の水は加熱すると縮む」と密接に関係しています。4℃で水の熱膨張率は0になり、それ以下では水は冷やすほど膨張しますから、その前後では、温度を変化させても水の体積はほとんど変わりません。4℃の水の密度がいちばん高いので、深海底の温度は世界中どこでも約4℃に保たれています。
熱膨張率が負になる液体は今のところ水しか知られておらず、極めて異常な性質と言えます。液体の熱膨張を利用した器具として、液柱温度計があります。通常はガラス管に着色した灯油を封入しますが、水を温度計に使うと、4℃付近ではほとんど温度変化を測れないばかりでなく、0℃〜4℃の目盛は4℃〜8℃の目盛と重なってしまいます。(さらに、0℃以下では氷がガラス管を割ってしまいます)水だけは、液柱温度計に使えないのです。

挿絵1 水だけは液柱温度計に使えない (CC BY-SA 2011 Pavel Ševela via Wikimedia)
通常の液体の熱膨張率は、例えばエタノールでは1.1×10–3 K–1、つまり液温が1℃上昇すると、体積が0.1%増えます。4 これはわずかだと思うかもしれません。そこで、次のような想像をしてみましょう。もし地球の海が、水ではなくエタノールでできていたとします。海の平均深さは3 700 mあります5 から、海水温ならぬ海「エタノール」温が1℃上昇しただけで、海面は4 m上昇することになります。幸いにも、深海の平均水温は約4℃(これも、4℃の水が最も密度が高くなる、水の異常な性質のおかげですが)なので、水温の多少の変化でも水はほとんど膨張せず、海面はほぼ一定に保たれます。6
15番「氷は融けると収縮する」も、水のほかにはシリコンなどごく限られた物質でしか起こらない現象です。7 氷のほうが密度がひくいおかげで、冬には湖面に平らできれいな氷が「張り」、スケートを楽しめます。もし湖が水以外の液体でできていたとしたら、凍結は湖底から起こり、湖面が凍るころには、湖は内部まですべて凍って収縮するため、湖面は陥没してでこぼこになります。さらに、凍結の途中で結晶に入りこめなかった不純物や、湖のなかの生物はすべて湖面に追いやられるので、ひどい風景と悪臭に悩まされることでしょう。
2番「沸点が異常に高い」性質は、61番の蒸発潜熱が大きいことや、71番の表面張力が大きいことと関連しています。水のなかでは、水分子が水素結合で互いに結びついています。水のように分子量が小さい分子の場合、一般には分子間力が弱く、沸点は低いし、気化熱(質量あたりの蒸発潜熱)も表面張力も小さいのが普通です。例えば、分子量が水(分子量18)に近いメタン(分子量16)の沸点は水よりも262 Kも低く、気化熱は水の1/4以下です。弱い水素結合を持つ硫化水素H2S(分子量34)でさえ、沸点は水よりも160 Kも低く、気化熱は水の1/3以下です。同じく水素結合を持つプロパノール(分子量80)でようやく沸点が水とほぼ同じになりますが、気化熱は水の1/3以下、表面張力も1/3以下しかありません。

挿絵2 表面張力で水にうかぶクリップ (CC BY-SA 2007 Armin Kübelbeck via Wikimedia)
先ほども述べたように、水は分子量あたりでいえば断トツで水素結合の数が多い物質です。このため、分子量のわりには分子間力が異常に強い物質と言えます。もし今突然に水の分子間力がメタンと同程度になると、地球の重力と気温では水はすべて気化し、大部分は宇宙に放散して、地球は「塩の惑星」になってしまうでしょう。8

挿絵3 塩の惑星!? (CC BY-ND 2.0 2011 Michael Theis via Flickr)
43番「水の誘電率は高い」は、蛇口から水を流して、静電気を帯びた下敷を近付けることで確認できます。エタノールの比誘電率は水の1/13しかないので、エタノールは下敷ではほとんど曲がらないでしょう。
このように、私たちが水について経験的に知っている性質のなかには、実は水でしか起こらない性質がとてもたくさんあります。水を知っていても、液体一般を理解したことにはならないし、液体一般の性質は、水にはそのままあてはまらないと思ったほうがよさそうです。
整理してみよう
表1に掲げた、水の異常な性質は、よく調べるといくつかの共通な原因があることがわかります。筆者はすべての異常の原因を説明できるわけではありませんが、わかる範囲で分類してみました。
- A: 分子量のわりに分子間力が大きいことによる性質。
- B: 水素原子が軽く、水分子が回転しやすいことや水素が脱着しやすいことによる性質。
- C: 過冷却水に2種類の状態があることによる性質。
- D: 水素結合が複雑なネットワーク構造を作れることや、通常の氷の密度が低いことによる性質
- E: A-D以外で、原因がわかっているもの。
- ?: その性質自体が正しいかどうか議論されていて確証されていないもの。
この中では、C群に属するものが圧倒的に多いことがわかります。そこで、C群を掘りさげてみましょう。
2種類の状態って何だ
C群に属する性質はいずれも、沸点近くの高温の水では異常はなく、水以外の液体と似たふるまいをするのに、温度を下げていくと、氷点(0℃)に近付くにつれ、あるいは過冷却水になることでどんどん異常になっていくという点で共通しています。過冷却水というのは、水を液体のまま0℃以下まで冷やした状態のことで、家庭用の冷凍庫でも作れますが、冷やしすぎると氷に変わってしまいます。図3に主要な物性値の、過冷却状態〜沸点の間での変化を示します。どれも、低温では高温とは逆の方向に変化していることがわかります。こんな変なふるまいをする物質は水以外にありません。
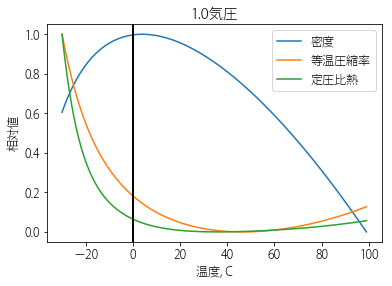
図3 過冷却〜沸点の水の諸物性。それぞれの物性を温度–30〜100℃での最大値が1、最小値が0となるようにスケールした。過冷却すると水は豹変する。
0℃よりすこし下まで水を冷やしても、凍らない限りは特別なことは何も起こらないように見えます。でも、深く過冷却すると、異常性が甚しくなり、それとともに過冷却状態を維持するのが難しくなって、容易に結晶化してしまうようになります。まるで、水が過冷却を拒んでいるようにも見えます。水は、その先に何を隠そうとしているのでしょうか。
科学者はさまざまな技術を駆使して、過冷却状態の先にあることをつきとめようとしてきました。その結果、驚くべきことが見えてきました。深く過冷却した水は、常温の水とはまったく別の液体に変わってしまうらしいのです。9 「まったく別」といっても、透明な液体であることには変わりないのですが、深く過冷却するほど図3のグラフの変化が急激になることからも、いろんな性質が常温の水とはかけはなれていることは想像できるでしょう。常温の水にみられる、C群のさまざまな異常な性質は、過冷却で起こる、もっと激しい異常のまえぶれにすぎないというのです。
面白いことに、水に三千気圧程度の圧力を加えながら過冷却した場合には、このような異常は何も起こらなくなります。水の密度は冷やすほど単調に高くなり、比熱も単調に減っていきます。過冷却しても特別なことは何も起こりません。高圧では、水は異常な液体ではないのです。(図4)

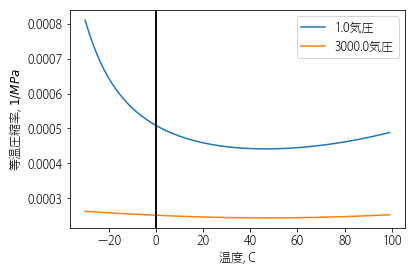
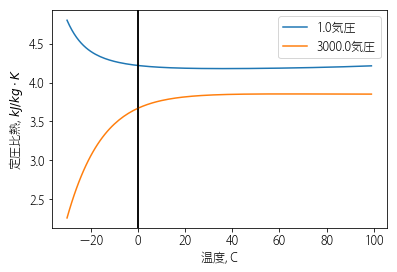
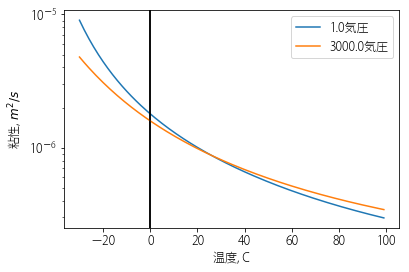
図4 1気圧と3000気圧での、水のさまざまな物性値の温度変化を比較した。10 外挿値なので確認が必要。
常圧では、水は高温になると普通の液体のようにふるまい、高圧では低温から高温まで普通の液体のようにふるまうということは、異常は常圧低温でだけ起こるということになります。では、常圧と高圧の中間の圧力で水を過冷却すると何がおこるでしょうか。理論的な考察によれば、この圧力で水を深く過冷却すると、正常な液体から異常な液体へ、相変化が起こると予測されています。氷が0℃で融けたり、水が100℃で沸騰するのも相変化の典型例ですが、それと同じように、過冷却水の相変化の時には、正常な水と異常な水という、全く性質の違う2種類の水が、互いにまじりあわず分離するというのです。

挿絵4 水が水と分離する?! (CC BY 2013 Masakazu Matsumoto via Flickr)
同じ分子からできている2種類の液体が、互いを弾きあって分離するなんて想像を絶します。実際、科学者の間でも大論争を巻きおこしました。11 実験でそのような状況を直接実現しようとしても、凍ってしまって観察することに誰も成功していないことも、疑念を抱かせる原因となりました。しかし、多数の実験が、間接的ながら、過冷却水には2種類の状態が存在することを支持しています。また、計算機シミュレーションにより、過冷却水が2種類に分離する様子が再現されています。その後、水以外の物質でも2種類の液体があるものがみつかりはじめ、2状態説が補強されています。12
まだまだ見つかる異常な性質
水のようなありふれた物質の性質について、21世紀になっても科学者が大論争をしていることは意外と思うことでしょう。水には、まだまだ未解明な性質があり、今でも科学の最先端で研究されていて、その謎が少しずつ解きあかされています。そして、ひとつの謎が解けると新たな謎がみつかります。19世紀末、研究者は氷に圧力を加えると結晶構造が変化することに驚きました13 が、20世紀の終わりまでに、氷の結晶構造には12種類もある14 ことを明らかにしました。圧力によって結晶構造が氷I→氷III→氷V→氷VIと次々に変化するので、土星の衛星ガニメデのように、地球よりもはるかに厚い氷がおおっている星では、表面から順に、4種類の氷が玉ねぎのように層をなしているという説もあります。15 単成分の物質が、こんなに多数の異なる結晶構造を作れるのは珍しいことでしたが、その後も氷の結晶構造の探索と発見は続き、氷の結晶構造には少なくとも17種類ある、というのが2019年時点の定説となっています。16 本稿で紹介した水の特異な性質のリストも、研究が進めばまだまだ長くなっていくことでしょう。そして、水に新しい性質がみつかれば、水に関連する分野では、これまでの常識を書き換えなければなりません。次はどんな性質がみつかるのでしょうか。
表1 水の異常な性質。記号の意味は本文を参照。
- 相の異常 融点が異常に高い。A
- 沸点が異常に高い。A
- 臨界点が異常に高い。A
- 結晶および非晶質の氷の種類が異常に多い。D
- 氷の熱伝導率、剪断弾性率および横方向音速は圧力の増加と共に減少する。 C
- 液体の水の構造は高圧で変化する。 C
- 過冷却水には二つの状態がある。C
- 液体の水を過冷却するのは容易だが、ガラス化するのは困難。 C
- 非常に低い温度で液体の水が存在し、それは加熱すると凍る。E
- 液体の水は容易に過熱する。A
- お湯は冷たい水より速く凍る? (Mpemba現象)
- 暖かい水は冷たい水よりも長時間振動する。 C
- 水分子は温度が上昇すると収縮し、圧力が上昇すると膨張する。 D
- 密度の異常 極低温の氷は加熱すると縮む。E
- 水は融けると収縮する。 D
- 圧力を加えると氷の融点が下がる。D
- 過冷却〜融点よりすこし上の温度の水は加熱すると縮む。C
- 水面はバルクの水よりも密度が高い。 C
- 圧力を加えると密度極大の温度(大気圧では約4℃)が下がる。 C
- 過冷却水の密度には最小値がある。 C
- 水は熱膨張率が低い。 C
- 水の熱膨張率は、低温では次第に減少し、やがて負になる。C
- 水の熱膨張率は圧力の増加とともに増加します。 C
- 最近接分子数は融解すると増加する。 D
- 最近接分子数は温度とともに増加する。C
- 常温の水の圧縮率は異常に低い。
- 温度が上昇するにつれて圧縮率は低下する。 (46.5℃まで)C
- 圧縮率 - 温度の関係に最大値がある。 C
- 温度が上昇するにつれて音速は増加する。 (74°Cまで)C
- 音速が最小になることがある。 C
- 高い周波数の「第二音速」があり、高圧では不連続性を示す。
- 核磁気共鳴のスピン - 格子緩和時間は低温では非常に短い。
- 核磁気共鳴シフトは低温(過冷却)で最大値をとる。
- 水の屈折率は0℃直下で最大値をとる。
- 液体が気体に変わるときの体積の変化は非常に大きい。
- 物質としての異常 水溶液は理想溶液ではない。 E
- 重水(D2O)および三重水(T2O)の物理的性質はH2Oと著しく異なる。 B
- 重水(D2O)および三重水(T2O)の液体は相挙動がH2Oと著しく異なる。B
- 重水(D2O)および三重水(T2O)の氷は量子挙動がH2Oと著しく異なる。 B
- 水の水素原子の平均運動エネルギーは低温で増加する?
- 溶質は密度や粘度などの特性にさまざまな影響を及す。C
- 非極性ガスの水への溶解度は、温度とともに最小値まで減少してから上昇する。C
- 水と氷の誘電率は高い。E
- 比誘電率が最大になる温度がある。
- 比誘電率は、温度が60°Cのときに屈曲する。
- 誘電率の虚数部は20 K付近で最小を示す。
- プロトンおよび水酸化物イオンの移動度は電場中で異常に速い。 B
- 水の導電率は約230℃で最大。
- 水の電気伝導度は周波数とともに上昇する。
- 弱酸の酸性度定数はある温度で最小になる。B
- X線回折は異常に詳細な構造を示す。
- 高圧下では、圧力が増すにつれて分子間距離はむしろ遠くなる。D
- 水の吸着によって負の電気抵抗を示す物質がある。
- 熱力学的異常 水の融解熱は、–17℃で最大。 C
- 水の比熱は氷や蒸気の2倍以上。C
- 水の(定圧・定積)比熱容量は異常に高い。C
- 定圧比熱容量は36℃で最小となる。C
- 定圧比熱容量は、約–45℃で最大となる。C
- 定圧比熱容量は圧力に関して最小値をとる。C
- 定積熱容量(CV)は極大を持つ。 C
- 蒸発熱が大きい。A
- 昇華熱が大きい。 A
- 気化エントロピーが大きい。A
- 水の熱伝導率は高く、約130℃で最大となる。B
- 水の物理的異常 水の粘度は異常に大きい。
- 温度が下がると、粘度とプラントル数が増加する。
- 水の粘度は33°C以下では圧力で減少する。C
- 温度が下がると拡散係数が急激に減少する。C
- 低温では、密度と圧力が増加するにつれて水の自己拡散係数が増加。C
- 熱拡散係数は約0.8 GPaで最大になる。
- 水の表面張力は異常に大きい。A
- 塩の水溶液のなかには、ある塩濃度で表面張力が最小になるものがある。 (Jones-Ray現象)
- 塩が水中の小さな泡の合体を妨げる。
- 塩のモルイオン体積は、温度に関して最大を示す。
References
- http://www1.lsbu.ac.uk/water/water_anomalies.html
- http://www.nims.go.jp/mana/moleculecarrace/index_jp.html
- https://en.wikipedia.org/wiki/Water_splitting
- 物理定数表、朝倉書店 (1978).
- https://en.wikipedia.org/wiki/Ocean
- 水の熱膨張率は温度に強く依存し、4℃付近の水はほとんど熱膨張しない一方、20℃の水はエタノールの1/5程度膨張します。今後、地球温暖化が進むと、海水の熱膨張率が急増して海面上昇が加速する懸念があります。
- https://ja.wikipedia.org/wiki/異常液体
- 平均深さ3 700 mの海からは、厚さ50 mの塩の層ができます!
- Osamu Mishima & H. Eugene Stanley, The relationship between liquid, supercooled and glassy water, Nature 396, 329–335 (1998).
- IAPWS, Revised Release on the IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use, September 2016, Table 5 http://www.iapws.org/relguide/IAPWS-95.html
- Mishima, O. & Stanley, H. E. The relationship between liquid, supercooled and glassy water. Nature 396, 329–335 (1998); Limmer, D. T. & Chandler, D. The putative liquid-liquid transition is a liquid-solid transition in atomistic models of water. J. Chem. Phys. 135, 134503 (2011).
- Kobayashi, M. & Tanaka, H. The reversibility and first-order nature of liquid–liquid transition in a molecular liquid. Nat Commun 7, 13438 (2016).
- Tammann, G. Ueber die Grenzen des festen Zustandes IV. Annalen der Physik 307, 1–31 (1900).
- Lobban, C., Finney, J. L. & Kuhs, W. F. The structure of a new phase of ice. Nature 391, 268–270 (1998).
- 「ガニメデ内部に多段重ねの海の層?」アストロアーツ 2014年5月7日 http://www.astroarts.co.jp/news/2014/05/07ganymede/index-j.shtml
- Salzmann, C. G. Advances in the Experimental Exploration of Water’s Phase Diagram. arXiv, 2018. https://arxiv.org/abs/1812.04333